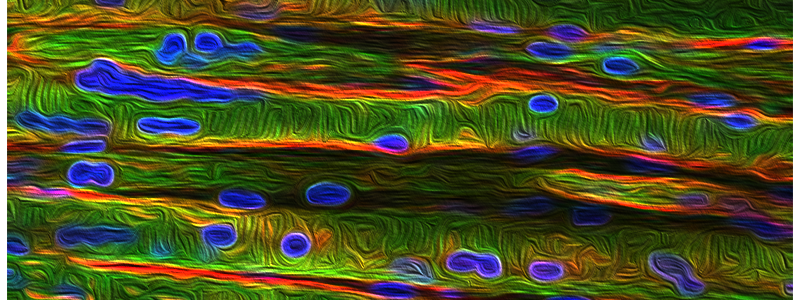
Figure 1 : Un WES et un RNA-seq ont conduit à la découverte d’un déséquilibre allélique spécifique au muscle. Un modèle de vers DM8005 rals5 traités avec de l’ARNi ciblant IARS a montré des signes de défauts musculaires précoces.
A) WES (à gauche) du sang total de chaque membre de la famille indique que la mère et les trois enfants sont hétérozygotes pour la mutation c.19826G>A. Le RNA-seq du tissu musculaire du patient II:1 (à droite) suggère une homozygotie pour l’allèle mutant. B) Le séquençage Sanger de l’ARN musculaire, lymphoblastique et fibroblastique du patient II:2 confirme non seulement le déséquilibre allélique, mais indique également la spécificité musculaire. C) Un modèle d’hérédité récessive. La dégradation de l’allèle paternel conduit à l’expression monoallélique de l’allèle maternel imitant un mode de transmission récessif. D) elegans (n = 75 par condition) exprimant GFP::MYO-3 (GFP fusionnée à une protéine de la chaîne lourde de C. elegans) dans les cellules musculaires ont été classés en niveaux « faible », « moyen » ou « élevé » de distorsion morphologique. E-F) Les vers nourris avec un ARNi ciblant IARS avaient un phénotype intermédiaire de désorganisation musculaire par rapport aux vers nourris aux bactéries OP50 (type sauvage), au vecteur vide (EV; contrôle négatif) et aux vers nourris à l’ARNi ciblant l’unc-89 (contrôle positif). E) Jour 1. F) Jour 3.
Description du projet
On estime que 25% des patients atteints de myopathies et dystrophies musculaire sont sans diagnostic moléculaire, malgré plusieurs investigations cliniques et génétiques. Plusieurs raisons expliquent ce phénomène : 1) focus sur l’étude de l’ADN, ce qui ne permet pas l’identification des variants intronique-régulateurs ou les événements d’épissage alternatifs; 2) l’impossibilité de déterminer l’impact fonctionnel en étudiant l’ADN seulement; 3) haute fréquence de variants de significations inconnues lors de test diagnostique. L’utilisation d’une combinaison d’approches omic avec la génomique fonctionnelle peut surmonter ces difficultés. En utilisant cette approche, nous avons identifié, chez des patients atteint de myopathie congénitale, un débalancement allélique muscle-spécifique dans le gène IARS1 encodant l’isoleucyl-tARN synthétase, une enzyme catalysant l’aminoacylation des tARN. Les patients de notre étude présentent seulement un phénotype au niveau des muscles ce qui est supporté par le débalancement allélique muscle-spécifique. Ce débalancement allélique peut être le résultat d’un variant intronique régulateur affectant l’expression et/ou la méthylation de l’ADN. Nous avons donc séquencé le génome et identifié un variant intronique situé à proximité d’une région méthylée. La diminution de l’expression de iars-1 dans un modèle C. elegans a démontré une désorganisation importante des fibres musculaires. Afin de pousser notre étude des mécanismes pathologiques associés avec une haploinsuffisance de IARS1 sur le muscle, nous travaillons à établir des modèles cellulaires primaires ou génétiquement édités. Nous avons établi la première association de IARS1avec un phénotype myopathique. Ces résultats permettent non seulement d’établir un diagnostic moléculaire pour cette famille mais permet aussi de caractériser un nouveau mécanisme pathologique impliquant une épimutation et mieux comprendre le rôle de IARS1 dans le muscle.
Équipe de recherche
Nom: Adrien Rihoux , BSc
Superviseur: Martine Tétrault (UDeM)
Lauréat: Bourse de maîtrise 2022